2020年5月6日,Science杂志官方网站发布了由中国医学科学院医学实验动物研究所秦川团队领衔,联合浙江省疾控中心张严峻团队、科兴控股生物技术有限公司、中国科学院生物物理研究所王祥喜团队、中国食品药品检定研究院、中国疾病预防控制中心传染病预防控制所等多家单位合作完成的研究文章Rapid development of aninactivated vaccine for SARS-CoV-2(《SARS-CoV-2病毒灭活疫苗的快速开发》)这是首个公开报道的新冠疫苗动物实验研究结果。此前的4月19日,该论文的预览版在生物科学预印本论文平台bioRxiv发布。

Science原文链接:https://science.sciencemag.org/lookup/doi/10.1126/science.abc1932
新冠病毒引起的COVID-19大流行给我们带来了前所未有的危机,对人类健康和生命造成巨大的威胁,给全球经济带来了灾难性的损失。迄今为止,还没有有效的针对新冠病毒的特异性抗病毒药物或可用的疫苗,因此迫切需要快速开发有效的新冠疫苗。研究者从11名感染了新冠病毒的住院患者(包括5名重症监护患者)的支气管肺泡灌洗液(BALF)中分离出多个新冠病毒毒株,其中5株来自中国,3株来自意大利,1例来自瑞士,1例来自英国,1例来自西班牙。这11个毒株广泛散在分布于基于所有可用序列构建的系统发育树上,在一定程度上代表了正在流行的病毒种群。在此基础上,研究者选择CN2株用于疫苗制备,开发了一种纯化的灭活新冠病毒候选疫苗(以下简称“候选疫苗”或“该疫苗”),并进行了中试生产。该疫苗在小鼠、大鼠和非人灵长类动物中均可诱导新冠病毒特异性中和抗体产生。这些抗体能有效地中和所选的其他10株(CN1、CN3-CN5和OS1-OS6)具有代表性的新冠病毒毒株,表明它们对世界范围内广泛流行的新冠病毒毒株都可能有潜在的中和能力。
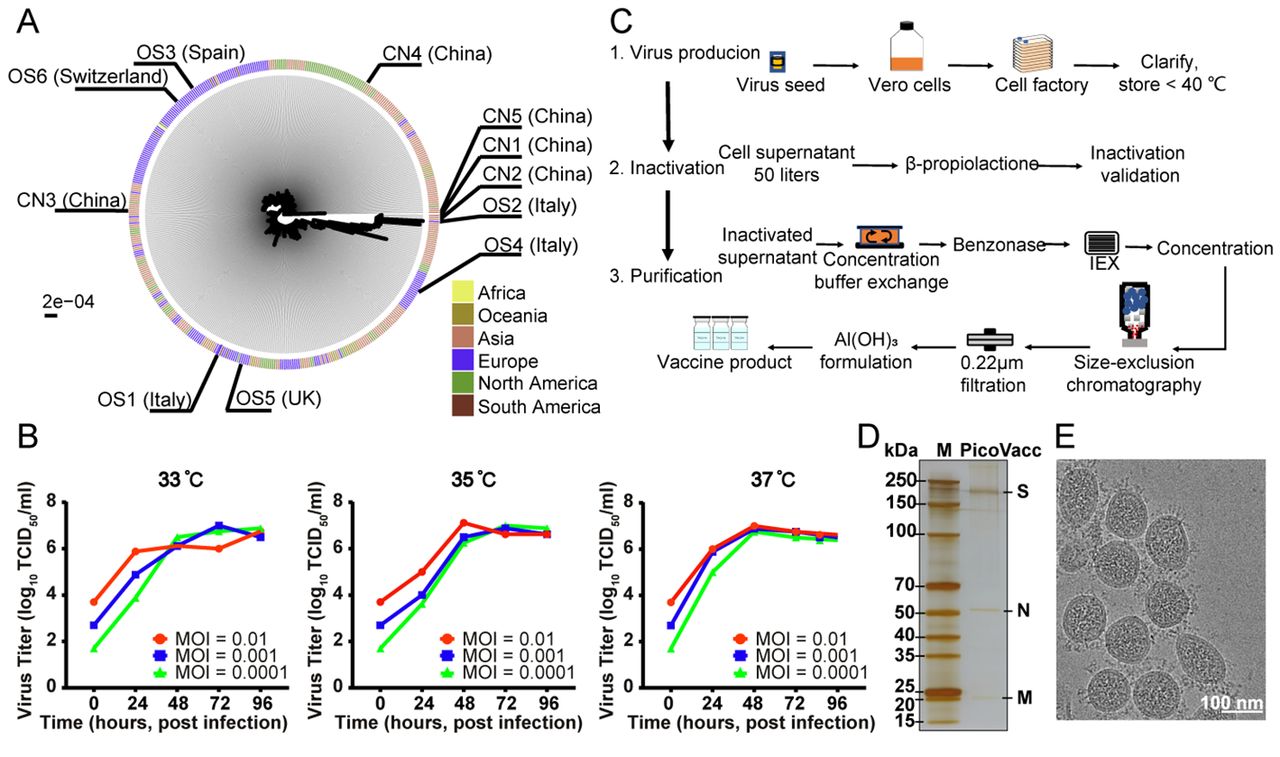
(A)SARS-CoV-2最大似然系统进化树。本研究中使用的SARS-CoV-2分离株已用黑线描绘并标记。分离病毒株的感染者所来自的各大洲已用不同颜色标注。(B)PiCoVacc(CN2)P5毒种库在Vero细胞中的生长动力学。(C)PiCoVacc制备流程图。(D)使用NuPAGE 4-12% Bis-Tris凝胶评价PiCoVacc的蛋白组成和纯度。(E)PiCoVacc的电子显微照片。比例尺为100nm。
为评价疫苗的免疫原性,研究者在第0天和第7天分别给小鼠接种不同剂量的候选疫苗后,未观察到炎症或其他不良反应,新冠病毒的S蛋白和RBD特异性的IgG在免疫后小鼠的血清中迅速产生,并于第6周达到滴度峰值。RBD特异的IgG在S蛋白诱导产生的抗体中占一半,提示RBD是主要的免疫原,这也与恢复期患者的血清学特征非常相似。与恢复期患者血清相比,该疫苗诱导出了更高滴度的S蛋白特异性抗体。
接下来,研究者使用微量中和试验(MN50)测定新冠病毒特异性中和抗体在一段时间内的水平。结果显示,高剂量免疫的中和抗体在初免后第1周出现,在第2周加强免疫后显著增加,在第7周达到峰值,而对照组则未检测到新冠病毒特异性抗体反应。研究者在大鼠中以及对不同毒株的实验中也得到了相似的结果。

图2. 新冠病毒灭活疫苗免疫诱导产生的抗体对10株SARS-CoV-2代表株的中和抗体反应
BALB/c小鼠和Wistar大鼠接种不同剂量的PiCoVacc或对照(空白对照组仅佐剂)(n=10)。恢复期COVID-19患者(RECOV)和非感染者(NI)血清分别作为阳性和阴性对照。分析小鼠(A)、人(B)和大鼠(C)的抗体反应。上图:ELISA法检测SARS-CoV-2特异的IgG应答;下图:微量中和实验检测中和抗体滴度。对PiCoVacc在小鼠(D)和大鼠(E)中诱导的中和活性谱也进行了研究。用免疫后3周收集的小鼠和大鼠血清进行另外9株SARS-CoV-2分离株的中和试验。数据点代表在动物和人类个体中5-10次独立实验的平均值±标准误,误差线表示标准误;虚线表示检测下限;水平线表示每组EC50的几何平均滴度(GMT)。
随后研究者在疫苗免疫后的恒河猴中进行了攻毒实验以评价疫苗免疫原性和保护效果。研究者在第0、7和14天给恒河猴接种不同剂量(3微克和6微克)的疫苗,结果显示,S蛋白特异性的IgG和中和抗体均在第2周被诱导出来,并在第3周继续增加,抗体滴度与恢复期的新冠患者的血清中的抗体滴度相似。
之后,研究者在第22天进行攻毒。结果显示,与对照组相比,疫苗免疫后的恒河猴肺部组织病理变化显著减小,病毒载量也显著下降。高剂量组的4只恒河猴感染后的第7天,咽喉、肛门和肺部都未检测到病毒,也没有观察到抗体依赖的增强(antibody-dependent enhancement,ADE)现象。中剂量组感染后第7天咽部、肛门和肺部标本中能部分检测到病毒,但与对照组相比病毒载量降低了约95%。结果表明,接种6微克剂量候选疫苗后可以对新冠病毒攻毒提供完全的保护,3微克剂量的疫苗有部分保护作用。
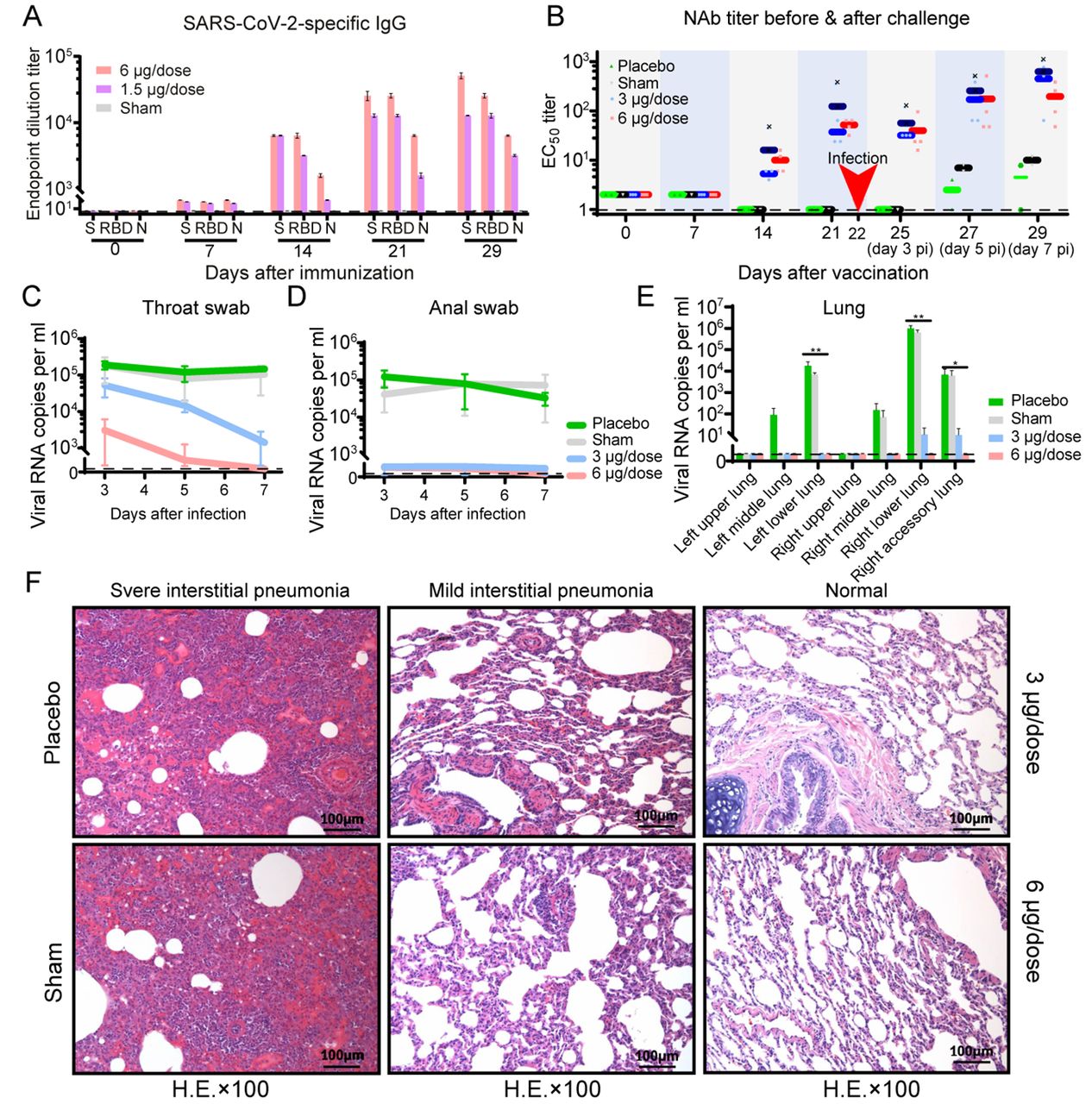
图3. 新冠病毒灭活疫苗在非人灵长类动物中的免疫原性和保护效果
用不同剂量的PiCoVacc、仅佐剂或安慰剂(n=4)通过肌肉注射途径对恒河猴进行三次免疫。测定SARS-CoV-2特异的IgG应答(A)和中和抗体滴度(B)。数据点表示恒河猴个体中4次独立实验的平均值±标准误,误差线表示标准误;虚线表示检测下限;水平线表示每组EC50的几何平均滴度(GMT)。(C-F)在恒河猴中观察PiCoVacc免疫后第3周对SARS-CoV-2攻毒的保护作用。在攻毒后第3、5和7天,对恒河猴咽拭子(C)和肛拭子(D)标本的病毒载量进行监测。(E)感染后第7天,检测所有接种病毒的恒河猴肺组织各叶的病毒载量。提取RNA,qRT-PCR检测病毒载量。所有数据均以4次独立实验的平均值±标准误表示,误差线表示标准误。星号表示显著性:*P < 0.05,**P < 0.01。(F)感染后第7天,所有接种病毒的恒河猴进行肺组织病理学检查。肺组织采集后使用苏木精和伊红染色。
研究者又通过观测临床指标和生化指数来验证该疫苗的安全性。他们发现,所有接种疫苗的恒河猴均未发现发烧和体重减轻现象,且食欲和精神状态都保持正常。在血液和生化分析方面,接种了疫苗的恒河猴的淋巴细胞亚群比例(CD3+、CD4+ 和CD8+)以及关键细胞因子(TNF-α、IFN-γ、IL-2、IL-4、IL-5和IL-6)与对照组相比均没有显著变化。此外,第29天对接种疫苗恒河猴的肺、心、脾、肝、肾和脑在内的各种器官组织的病理学评估表明,该疫苗也没有引起显著的病理学特征,以上结果表明候选疫苗在恒河猴中具有安全性。
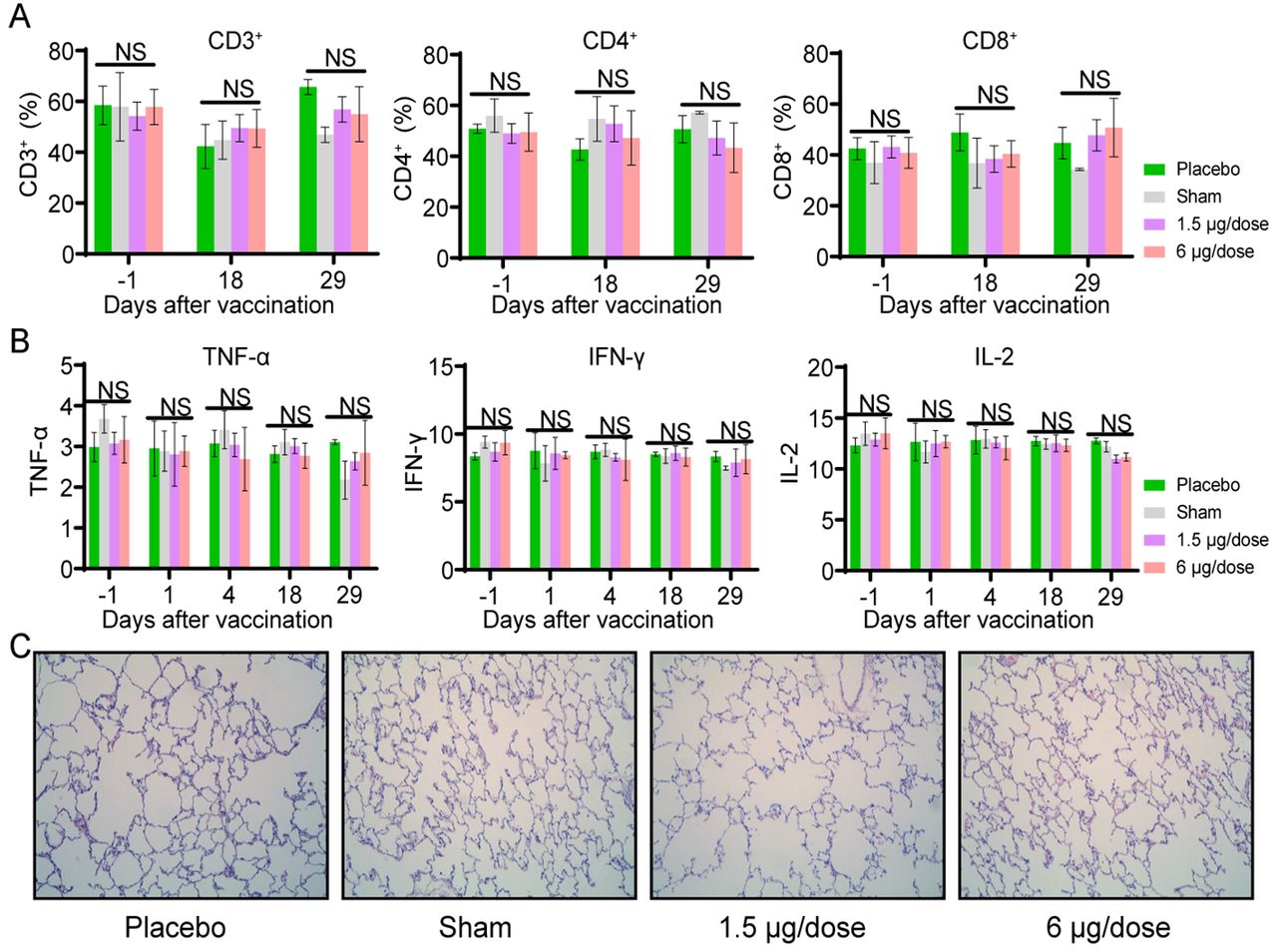
图4. 新冠病毒灭活疫苗在非人类灵长类动物中的安全性评价第0、7和14天,使用低剂量(1.5μg/剂)或高剂量(6μg/剂)PiCoVacc、仅佐剂(空白对照)或安慰剂,通过肌肉注射对猴进行三次免疫。(A和B)四组猴的血液学分析(n=4)。(A)在第-1天(接种前1天)、第18天和第29天监测淋巴细胞亚群百分比,包括CD3+、CD4+和CD8+。(B)在第-1、1(第1次接种当天)、4、18、29天检测关键细胞因子,包括TNF-α、IFN-γ和IL-2。数值点表示4次独立实验的平均值±标准差,误差线表示标准差。(C)四组猴第29天,肺组织病理学评价。采集肺组织,并使用苏木精和伊红染色。基于上述研究结果,国家药品监督管理局已于2020年4月13日批准科兴控股生物技术有限公司旗下北京科兴中维生物技术有限公司(“科兴中维”)研制的新型冠状病毒灭活疫苗克尔来福™️进入临床研究,Ⅰ/Ⅱ期临床研究于4月16日在江苏省徐州市睢宁县正式启动。中国医学科学院医学实验动物研究所所长秦川教授,浙江省疾病预防控制中心微生物所所长张严峻研究员,科兴控股生物技术有限公司董事长、总裁兼CEO及科兴新冠灭活疫苗项目总负责人尹卫东,中国科学院生物物理研究所王祥喜研究员,中国食品药品检定研究院李长贵研究员和中国疾病预防控制中心传染病预防控制所卢金星研究员为本研究的通讯作者。科兴新冠灭活疫苗项目研发负责人、科兴中维总经理高强,中国医学科学院的鲍琳琳博士,浙江省疾控中心的茅海燕博士, 科兴中维病毒性疫苗总监王琳,中国食品药品检定研究院的徐康维博士和中国科学院生物物理研究所的杨闽楠博士为该论文的共同第一作者。
以下为论文官方翻译稿:
高强1$,鲍琳琳2$,茅海燕4$, 王琳1$,徐康维7$,杨闽楠3$,李雅静1,朱玲3,王男3,吕哲3,高虹2,戈小琴1,阚飙5,胡雅灵1,刘江宁2,蔡芳1,姜德玉1,阴彦辉1,秦成峰6,李静1,公雪杰1,楼秀玉4,史雯4,吴冬冬1,张恒铭1,朱朗1,邓巍2,李育蓉1,卢金星5*,李长贵7*,王祥喜3*,尹卫东1*,张严峻4*,秦川2*2、国家卫生健康委员会人类疾病比较医学重点实验室,中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,新发再发传染病动物模型研究北京市重点实验室3、中国科学院感染与免疫重点实验室,生物大分子国家重点实验室,中国科学院生物物理研究所摘要:由SARS-CoV-2病毒引起的COVID-19大流行已造成了一场史无前例的公共卫生危机。SARS-CoV-2作为一种新发现的病毒,目前尚无可用的针对该病毒的疗法或疫苗。因此,迫切需要快速开发出有效的抵抗SARS-CoV-2病毒的疫苗。本文介绍了我们开发的一种纯化灭活的SARS-CoV-2候选疫苗(PiCoVacc)的中试生产,此候选疫苗在小鼠,大鼠和非人灵长类中均可诱导SARS-CoV-2特异的中和抗体产生,并且这些抗体可以有效地中和10株有代表性的SARS-CoV-2病毒,表明其可能在SARS-CoV-2病毒中具有更广泛的中和能力。在两个不同剂量(3μg或6μg每剂)下,3剂的免疫程序可以分别在猴中达到部分或完全的SARS-CoV-2攻毒保护效果,且未观察到任何抗体依赖性感染增强作用。这些数据都支持了SARS-CoV-2人用疫苗的临床开发。一句话总结:一种纯化灭活的SARS-CoV-2候选疫苗(PiCoVacc)通过诱导无免疫损伤的有效体液免疫,在非人灵长类动物中达到对目前全球流行的SARS-CoV-2病毒株的完全保护作用正文:世界卫生组织于2020年1月30日宣布2019年爆发的新型冠状病毒肺炎(COVID-19)为国际公共卫生紧急事件,并于2020年3月11日宣布为大流行。据报道,COVID-19患者中约80%表现为轻度至中度症状,约20%出现严重临床表现,如重度肺炎、急性呼吸窘迫综合征(ARDS)、败血症甚至死亡(1)。COVID-19病例的数量在全球以惊人的速率增加。目前大流行的病原体——严重急性呼吸综合征-冠状病毒2(SARS-CoV-2)属于冠状病毒科,β-冠状病毒属(2)。SARS-CoV-2与严重急性呼吸综合征冠状病毒(SARS-CoV)和中东部呼吸综合征相关冠状病毒(MERS-CoV)共同构成了人类冠状病毒中三种对生命威胁最为严重的冠状病毒。SARS-CoV-2具有线性的单链正链RNA基因组,编码4种结构蛋白(包括刺突蛋白(S)、包膜蛋白(E)、膜蛋白(M)和核衣壳蛋白(N)),16种非结构蛋白(nsp1-nsp16)和几种辅助蛋白。其中,S蛋白是诱导高效中和抗体(NAbs)的主要保护性抗原(3)。目前,还没有针对新出现的SARS-CoV-2病毒的特异性抗病毒药物或疫苗可用。因此,为遏制这次新型冠状病毒肺炎大流行并防止新的病毒爆发,紧急开发疫苗是至关重要的。目前有多种SARS-CoV-2疫苗正在开发,如DNA、RNA疫苗、含病毒表位的重组亚单位疫苗、腺病毒载体疫苗和纯化灭活病毒疫苗(4-6)。经纯化的灭活病毒在传统上已被用于疫苗开发,并且已发现其可以安全有效的预防由病毒(例如流感病毒和脊髓灰质炎病毒)引起的疾病(7,8)。为了开发SARS-CoV-2候选疫苗的临床前体外中和与攻毒模型,我们采集了11例住院患者(包括5例重症监护患者)的支气管肺泡灌洗液(BALF),其中5例来自中国,3例来自意大利,1例来自瑞士,1例来自英国,1例来自西班牙(表S1),并从中分离出SARS-CoV-2病毒株。这些患者在最近一次爆发期间感染了SARS-CoV-2。从所采集的11个样本中分离的SARS-CoV-2病毒株广泛分布于基于所有可用病毒序列构建的系统进化树上,一定程度上代表了正在流行的病毒种群(图1A,图S1)。我们选择了病毒株CN2用于开发纯化灭活SARS-CoV-2疫苗(PiCoVacc),并用其他10株(CN1、CN3-CN5和OS1-OS6)作为临床前研究的攻毒株。值得注意的是, CN1和OS1株分别与2019-nCoV-BetaCoV/Wuhan/WIV04/2019和EPI_ISL_412973密切相关,而这两株病毒可引起严重的临床症状(如需要机械通气的呼吸衰竭)(9,10)。为了获得适于在Vero细胞中高效生长的病毒种子库,以生产PiCoVacc,CN2毒株首先在Vero细胞中进行纯化,并传代一次,获得P1毒种库。此后再进行四次传代,获得P2-P5毒种库。对P5毒种库在Vero细胞中的生长动力学分析表明该毒种库可以高效复制,在33℃-37℃且感染复数(MOI)为0.0001-0.01时,于感染后3或4天内(dpi)达到6-7 log10 TCID50/ml的峰值滴度(图1B)。为评价PiCoVacc的遗传稳定性,我们进一步进行了5次传代并获得P10毒种库,并对P1、P3、P5及P10代毒种库进行了全基因组测序。与P1相比,仅两个氨基酸替换发生于P5和P10毒种库中,分别是E蛋白32位的Ala→Asp (E-A32D)和nsp10蛋白49位的Thr→Ile(nsp10-T49I)(表S2),提示PiCoVacc-CN2毒株具有良好的遗传稳定性,没有发生可能引起NAb表位改变的S蛋白突变。为了生产用于动物研究的中试规模的PiCoVacc,使用细胞工厂,在Vero细胞(50升培养液)中进行病毒培养,并使用β-丙内酯灭活病毒(图1C)。利用深层过滤和两步优化色谱纯化病毒,制备得到高纯度的PiCoVacc制剂(图1D)。并且,通过冷冻电镜(cryo-EM)分析,病毒形态显示为完整的、直径90-150纳米的椭圆形颗粒,带有冠状刺突,表现为病毒的融合前构象(图1E)。为评价PiCoVacc的免疫原性,对多组BALB/c小鼠(n=10)于第0天和第7天分别注射不同剂量的PiCoVacc(Al(OH)3佐剂)(0、1.5、3或6μg每剂,0μg/生理盐水用作对照组)。未观察到炎症或其他不良反应。在初次免疫后的第1-6周,通过酶联免疫吸附试验(ELISA)评估S蛋白、受体结合域(RBD)和N蛋白特异性的抗体反应(图S2)。SARS-CoV-2 S蛋白特异和RBD特异的免疫球蛋白G(IgG)在免疫后小鼠的血清中迅速产生,并于第6周分别达到819,200(>200μg/ml)和409,600(>100μg/ml)的滴度峰值(图2A)。RBD特异的IgG在S蛋白诱导产生的抗体应答中占一半,提示着RBD是主要的免疫原,这也与恢复期COVID-19患者的血清学特征非常吻合(图2A和2B)(11)。令人惊讶的是,在免后小鼠中,N蛋白特异的IgG的诱导量比靶向S或RBD的抗体低约30倍(图2A)。有趣的是,先前的研究表明,N蛋白特异的IgG在COVID-19患者的血清中大量存在,已被视为一种临床诊断标志物(11)。值得注意的是,PiCoVacc在小鼠中可以诱导的S蛋白特异抗体滴度比其在COVID-19恢复期患者血清的滴度高出约10倍。尽管目前观察到的现象不足以说明PiCoVacc可以在人体中诱导产生类似的结果,但依然提示着PiCoVacc有可能诱导强而有效的免疫应答。综上所述,结合我们的发现,以及靶向SARS-CoV-2 N蛋白的抗体并不能提供抵抗病毒感染的保护性免疫(12)这一事实,提示着PiCoVacc有可能诱导更有效的抗体应答(图2A和2B)。接下来,我们用微量中和试验(MN50)测定了SARS-CoV-2特异的中和抗体在一段时间内的变化。与S蛋白特异的IgG应答相似,抗CN1株的中和抗体滴度在第1周出现(高剂量免疫组为12),在第2周加强免疫后激增,并于第7周分别达到1,500(中低剂量组)和3,000(高剂量组)上下(图2A)。相反,对照组没有产生可检测水平的SARS-CoV-2特异的抗体应答(图2A和2B)。此外,用同样的免疫策略在Wistar大鼠中进行PiCoVacc的免疫原性评估,也得到了相似的结果——中和抗体最大滴度于第7周达到2,048-4,096(图2C)。为了研究PiCoVacc诱导的中和活性谱,我们用接种后3周采集的小鼠和大鼠血清对分离得到的另外9株SARS-CoV-2病毒进行了中和试验。对这些病毒株的中和滴度表明,PiCoVacc可能诱导能够有效中和全球流行的SARS-Cov-2毒株的抗体产生(图2D和2E)。此后,我们评估了PiCoVacc在恒河猴(Macaca mulatta)中的免疫原性和保护效果。恒河猴是一种非人灵长类动物,在SARS-CoV-2感染后表现出COVID-19样疾病(13)。在第0、7和14天,通过肌肉注射中剂量(3μg/剂量)或高剂量(6μg/剂量)PiCoVacc的方式免疫恒河猴3次(n=4)。在第二周,两个接种组均已诱导产生S蛋白特异性IgG和NAb,并且其滴度在第3周(攻毒前)分别上升到~12,800和~50,与恢复期的COVID-19患者的血清滴度相似(图3A和3B)。出乎意料的是,在第3周时,中剂量免疫组的NAb滴度(61)比高剂量免疫组同期观察值(50)高出约20%,这可能是由于中剂量组内1只动物的个体差异——该动物中诱导产生了比其他3只动物高约十倍的抗体滴度(图3B)。剔除此异常值后,中剂量组的NAb滴度下降到34,比高剂量组滴度低约40%。随后,我们在第22天(第3次免疫后1周)进行了免疫组和对照组恒河猴的攻毒研究,通过气管将106 TCID50的SARS-CoV-2 CN1直接接种到动物肺中,以验证疫苗保护效果。结果如我们所预期,所有对照组(空白对照组和安慰剂组)恒河猴于接种病毒后第3-7天(dpi),在咽部、肛周和肺部都检测到了极大量的病毒基因组RNA(104-106/ml),并出现严重间质性肺炎(图3C-3F)。相反,所有接种过候选疫苗的恒河猴都能在很大程度上抵御SARS-CoV-2感染,仅在少数肺叶有非常轻微的局限性组织病理学改变,这种病变可能是由于研究中将106 TCID50的病毒通过气管直接接种到肺部,从而需要更长的时间(超过一周)才能完全恢复(图3F)。从感染后第3-7天起,所有接种过候选疫苗的恒河猴中的病毒载量显著减少,而对照动物的病毒载量略有增加(图3C-3E)。感染后第7天,4只高剂量组的恒河猴的咽部、肛周和肺中均未检测到病毒。在中剂量组中,我们确实在感染后第7天的部分动物中检测到了病毒信号,分布于咽部(3/4)、肛周(2/4)和肺部(1/4)样本中,然而其病毒载量与空白对照组相比减少了约95%(图3C-3E)。有趣的是,免疫组的NAb滴度在感染后3天下降了约30%以中和病毒,然后在感染后5-7天迅速升高,维持了其强有力的中和效果。与高剂量组(滴度约145)相比,中剂量组在感染后第7天观察到了更高的NAb滴度(4只恒河猴,约400)。这可能是由于此阶段病毒复制水平相对较低,也提示着需要更长的时间才能完全清除病毒。尽管在病毒感染前中剂量组的NAb滴度相对较低,提供了部分保护,并未观察到免疫后恒河猴中出现抗体依赖性感染增强(ADE)。在此项研究中,不能排除抗体滴度衰减后表现出ADE的可能性。此问题将在已批准的进一步研究中得到确认,包括免后更长时间的动物攻毒研究。过去关于SARS和MERS疫苗研发的报道引起了人们对肺免疫损伤的关注,或由2型辅助T细胞(Th2)应答直接引起,或由ADE引起(4,14,15)。尽管在许多疫苗中都已证明,其诱导的T细胞应答对急性病毒感染的清除至关重要,但对冠状病毒感染的保护主要还是通过体液免疫介导的(16,17)。实际上,由过度的T细胞应答所引起的“细胞因子风暴”已被证明可加剧COVID-19的发病(18,19)。因此,必须很好的控制SARS-CoV-2疫苗诱导的T细胞应答,防止出现免疫损伤。在此前提下,我们记录了一些临床观察和生物学指标,系统地评估了PiCoVacc在猴中的安全性。两组猴(n=10)分别在第0、7、14天肌肉注射低剂量(1.5μg)或高剂量(6μg)候选疫苗,另两组猴(n=10)注射佐剂(空白对照组)或生理盐水(安慰剂组)。在接种PiCoVacc的猴中,没有观察到任何发热或体重下降,所有动物的食欲和精神状态均保持正常(图S3)。血液学和生化分析,包括血生化检测、淋巴细胞亚群百分比(CD3+、CD4+和CD8+)和关键细胞因子(TNF-α、IFN-γ、IL-2、IL-4、IL-5和IL-6)的分析结果显示,与空白对照组和安慰剂组相比,免疫组均未出现明显变化(图4A-4B和图S4-S5)。此外,在第29天,对4组动物的各器官,包括肺、心、脾、肝、肾和脑的组织病理学评估结果显示,PiCoVacc在猴中没有引起任何明显的病理变化(图4C和图S6)。当前,基于COVID-19的严重大流行和世界范围内死亡人数的急剧增加,迫切需要紧急开发一种SARS-CoV-2疫苗,这需要一种大流行下的新模式。在临床前研究和临床试验的两个阶段,疫苗的安全性和有效性对其开发至关重要。尽管目前确定研究SARS-CoV-2感染的最佳动物模型还为时尚早,但SARS-CoV-2感染后模拟出COVID-19样症状的恒河猴作为研究该疾病的动物模型,应该具有较好的应用前景。我们为PiCoVacc在猴中应用的安全性提供了大量的证据,在我们的研究中也没有观察到感染增强或免疫损伤恶化。我们的数据还显示,每剂6μg的PiCoVacc可以在SARS-CoV-2攻毒研究中为恒河猴提供完全的保护作用。总之,这些结果为人用SARS-CoV-2疫苗的临床开发指明了方向。PiCoVacc以及其他SARS-CoV-2候选疫苗的Ⅰ期、Ⅱ期和Ⅲ期临床试验预期将随后于今年开始。
参考文献:
1. Z. Wu, J. M. McGoogan, Characteristics of and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in China: Summary of a report of 72,314 cases from the Chinese Center for Disease Control and Prevention. JAMA 323, 1239–1242 (2020). doi:10.1001/jama.2020.2648pmid:32091533
2. Coronaviridae Study Group of the International Committee on Taxonomy of Viruses, The species severe acute respiratory syndrome-related coronavirus: Classifying 2019-nCoV and naming it SARS-CoV-2. Nat. Microbiol. 5, 536–544 (2020). doi:10.1038/s41564-020-0695-zpmid:32123347
3. A. Wu, Y. Peng, B. Huang, X. Ding, X. Wang, P. Niu, J. Meng, Z. Zhu, Z. Zhang, J. Wang, J. Sheng, L. Quan, Z. Xia, W. Tan, G. Cheng, T. Jiang, Genome composition and divergence of the novel coronavirus (2019-nCoV) originating in China. Cell Host Microbe 27, 325–328 (2020). doi:10.1016/j.chom.2020.02.001pmid:32035028
4. N. Lurie, M. Saville, R. Hatchett, J. Halton, Developing Covid-19 vaccines at pandemic speed. N. Engl. J. Med. 10.1056/NEJMp2005630 (2020). doi:10.1056/NEJMp2005630pmid:32227757
5. K. Dhama, K. Sharun, R. Tiwari, M. Dadar, Y. S. Malik, K. P. Singh, W. Chaicumpa, COVID-19, an emerging coronavirus infection: Advances and prospects in designing and developing vaccines, immunotherapeutics, and therapeutics. Hum. Vaccin. Immunother. 10.1080/21645515.2020.1735227 (2020). doi:10.1080/21645515.2020.1735227pmid:32186952
6. E. Kim, G. Erdos, S. Huang, T. W. Kenniston, S. C. Balmert, C. D. Carey, V. S. Raj, M. W. Epperly, W. B. Klimstra, B. L. Haagmans, E. Korkmaz, L. D. Falo Jr., A. Gambotto, Microneedle array delivered recombinant coronavirus vaccines: Immunogenicity and rapid translational development. EBioMedicine 102743 (2020). doi:10.1016/j.ebiom.2020.102743pmid:32249203
7. A. D. Murdin, L. Barreto, S. Plotkin, Inactivated poliovirus vaccine: Past and present experience. Vaccine 14, 735–746 (1996). doi:10.1016/0264-410X(95)00211-Ipmid:8817819
8. C. Vellozzi, D. R. Burwen, A. Dobardzic, R. Ball, K. Walton, P. Haber, Safety of trivalent inactivated influenza vaccines in adults: Background for pandemic influenza vaccine safety monitoring. Vaccine 27, 2114–2120 (2009). doi:10.1016/j.vaccine.2009.01.125pmid:19356614
9. P. Stefanelli, G. Faggioni, A. Lo Presti, S. Fiore, A. Marchi, E. Benedetti, C. Fabiani, A. Anselmo, A. Ciammaruconi, A. Fortunato, R. De Santis, S. Fillo, M. R. Capobianchi, M. R. Gismondo, A. Ciervo, G. Rezza, M. R. Castrucci, F. Lista; On Behalf of Iss Covid-Study Group, Whole genome and phylogenetic analysis of two SARS-CoV-2 strains isolated in Italy in January and February 2020: Additional clues on multiple introductions and further circulation in Europe. Euro. Surveill. 25, 2000305 (2020). doi:10.2807/1560-7917.ES.2020.25.13.2000305pmid:32265007
10. P. Zhou, X.-L. Yang, X.-G. Wang, B. Hu, L. Zhang, W. Zhang, H.-R. Si, Y. Zhu, B. Li, C.-L. Huang, H.-D. Chen, J. Chen, Y. Luo, H. Guo, R.-D. Jiang, M.-Q. Liu, Y. Chen, X.-R. Shen, X. Wang, X.-S. Zheng, K. Zhao, Q.-J. Chen, F. Deng, L.-L. Liu, B. Yan, F.-X. Zhan, Y.-Y. Wang, G.-F. Xiao, Z.-L. Shi, A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature 579, 270–273 (2020). doi:10.1038/s41586-020-2012-7pmid:32015507
11. L. Liu, S. Wang, S. Zheng, A preliminary study on serological assay for severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) in 238 admitted hospital patients. MedRxiv 2020.03.06.20031856 [Preprint]. 8 March 2020; .doi:10.1101/2020.03.06.20031856
12. L. E. Gralinski, V. D. Menachery, Return of the coronavirus: 2019-nCoV. Viruses 12, E135 (2020). doi:10.3390/v12020135pmid:31991541
13. P. Yu, F. Qi, Y. Xu, F. Li, P. Liu, J. Liu, L. Bao, W. Deng, H. Gao, Z. Xiang, C. Xiao, Q. Lv, S. Gong, J. Liu, Z. Song, Y. Qu, J. Xue, Q. Wei, M. Liu, G. Wang, S. Wang, H. Yu, X. Liu, B. Huang, W. Wang, L. Zhao, H. Wang, F. Ye, W. Zhou, W. Zhen, J. Han, G. Wu, Q. Jin, J. Wang, W. Tan, C. Qin, Age-related rhesus macaque models of COVID-19. Animal Model. Exp. Med. 3, 93–97 (2020). doi:10.1002/ame2.12108pmid:32318665
14. C. T. Tseng, E. Sbrana, N. Iwata-Yoshikawa, P. C. Newman, T. Garron, R. L. Atmar, C. J. Peters, R. B. Couch, Correction: Immunization with SARS coronavirus vaccines leads to pulmonary immunopathology on challenge with the SARS virus. PLOS ONE 7, e35421 (2012). doi:10.1371/annotation/2965cfae-b77d-4014-8b7b-236e01a35492pmid:22536382
15. C. Y. Yong, H. K. Ong, S. K. Yeap, K. L. Ho, W. S. Tan, Recent advances in the vaccine development against Middle East respiratory syndrome-coronavirus. Front. Microbiol. 10, 1781 (2019). doi:10.3389/fmicb.2019.01781pmid:31428074
16. E. Prompetchara, C. Ketloy, T. Palaga, Immune responses in COVID-19 and potential vaccines: Lessons learned from SARS and MERS epidemic. Asian Pac. J. Allergy Immunol. 38, 1–9 (2020). pmid:32105090
17. J. Zhao, R. A. P. M. Perera, G. Kayali, D. Meyerholz, S. Perlman, M. Peiris, Passive immunotherapy with dromedary immune serum in an experimental animal model for Middle East respiratory syndrome coronavirus infection. J. Virol. 89, 6117–6120 (2015). doi:10.1128/JVI.00446-15pmid:25787284
18. J. M. Nicholls, L. L. M. Poon, K. C. Lee, W. F. Ng, S. T. Lai, C. Y. Leung, C. M. Chu, P. K. Hui, K. L. Mak, W. Lim, K. W. Yan, K. H. Chan, N. C. Tsang, Y. Guan, K. Y. Yuen, J. S. Peiris, Lung pathology of fatal severe acute respiratory syndrome. Lancet 361, 1773–1778 (2003). doi:10.1016/S0140-6736(03)13413-7pmid:12781536
19. H. Y. Zheng, M. Zhang, C. X. Yang, N. Zhang, X. C. Wang, X. P. Yang, X. Q. Dong, Y. T. Zheng, Elevated exhaustion levels and reduced functional diversity of T cells in peripheral blood may predict severe progression in COVID-19 patients. Cell. Mol. Immunol. 17, 541–543 (2020). doi:10.1038/s41423-020-0401-3pmid:32203186
20. J. Miller, R. Ulrich, On the analysis of psychometric functions: The Spearman-Kärber method. Percept. Psychophys. 63, 1399–1420 (2001). doi:10.3758/BF03194551pmid:11800465
21. L. T. Nguyen, H. A. Schmidt, A. von Haeseler, B. Q. Minh, IQ-TREE: A fast and effective stochastic algorithm for estimating maximum-likelihood phylogenies. Mol. Biol. Evol. 32, 268–274 (2015). doi:10.1093/molbev/msu300pmid:25371430
22. G. C. Yu, D. K. Smith, H. C. Zhu, Y. Guan, T. T. Y. Lam, GGTREE: An R package for visualization and annotation of phylogenetic trees with their covariates and other associated data. Methods Ecol. Evol. 8, 28–36 (2017). doi:10.1111/2041-210X.12628
23. N. Wang, D. Zhao, J. Wang, Y. Zhang, M. Wang, Y. Gao, F. Li, J. Wang, Z. Bu, Z. Rao, X. Wang, Architecture of African swine fever virus and implications for viral assembly. Science 366, 640–644 (2019). doi:10.1126/science.aaz1439pmid:31624094
关于SINOVAC科兴
科兴控股生物技术有限公司(Sinovac Biotech Ltd.,SINOVAC 科兴)是一家总部位于中国、面向全球的生物制药企业,公司以“为人类消除疾病提供疫苗”为使命,专注于人用疫苗及相关生物制品的研究、开发、生产和供应,为全球疾病防控提供高质量疫苗产品和相关解决方案。
SINOVAC 科兴拥有多元化的疫苗产品组合,覆盖流感、病毒性肝炎、水痘、手足口病、脊髓灰质炎、肺炎球菌性疾病等多个重点领域。其中,甲型肝炎灭活疫苗孩尔来福®、Sabin 株脊髓灰质炎灭活疫苗(sIPV)和水痘减毒活疫苗已通过世界卫生组织(WHO)预认证。
在应对新兴传染病方面,SINOVAC 科兴具有领先优势,在SARS、H5N1、H1N1及新冠疫情等多次重大公共卫生事件中率先开展疫苗研发,并先后研制出全球首支SARS灭活疫苗(完成I期临床)、中国第一支大流行流感灭活疫苗(H5N1)盼尔来福®、全球首支甲型H1N1流感疫苗盼尔来福.1®,以及全球应用最广泛的新冠灭活疫苗克尔来福®。
除已上市产品之外,SINOVAC 科兴正持续推进涵盖联合疫苗、重组蛋白疫苗以及mRNA、抗体等新一代技术平台的创新研发管线,进一步拓展疾病预防的技术边界。
秉持对创新与全球健康的长期承诺,SINOVAC 科兴不断深化与科研机构、国际组织及本地合作伙伴的合作,拓展全球业务布局。通过加强技术协作、推动本地化生产与产业合作,公司致力于加快疫苗研发与供应速度,提升高质量疫苗在不同地区的可及性,更好地满足不同地区尚未满足的医疗需求,提升对未来公共卫生挑战的应对能力。





 中文
中文