北京科兴生物制品有限公司关于潘爱华先生及北大未名集团方面虚假举报并散布不实信息的声明
近日,潘爱华先生及北大未名集团方面多次向相关部门恶意举报北京科兴生物制品有限公司(“北京科兴”)违规违法等不实信息,并数次召开媒体见面会,编造、散播北京科兴相关内容,部分媒体仅据单方面不实信息发布失实稿件。对此,北京科兴公司董事会授权北京科兴公司郑重声明如下:
一、根据法律及北京科兴公司章程规定,董事会是中外合资企业北京科兴生物制品有限公司的最高权力机构。董事会决定北京科兴的一切重大事宜。
二、尹卫东先生目前受董事会指派履行公司管理职责。北京科兴在管理团队领导下运营稳定,企业负责人、质量负责人、生产负责人均在药监部门备案。
三、潘爱华先生或其他任何个人、法人、其他组织对外宣扬或陈述的内容在未经北京科兴董事会批准的情况下均不能代表北京科兴,不可取代北京科兴对外发布、披露的声明及事实。
四、就潘爱华先生实施的侵害北京科兴权益的不法行为,北京科兴董事会已授权北京科兴公司向人民法院提起诉讼。
公司董事会认为潘爱华先生作为小股东代表,应立即停止一切非法行为,也敦促潘爱华先生停止为实现个人非法目的而对公司正常生产经营及管理层没有依据的恶意攻击。公司保留进一步追究潘爱华先生及相关单位法律责任的权利。
根据《中华人民共和国药品管理法实施条例》(2016年2月6日修正版)第二章第四条规定,药品生产企业变更《药品生产许可证》许可事项的,应当在许可事项发生变更30日前,向原发证机关申请《药品生产许可证》变更登记;未经批准,不得变更许可事项。原发证机关应当自收到申请之日起15个工作日内作出决定。北京科兴《药品生产许可证》(2017年10月30日签发)中注明的北京科兴质量负责人为李静女士,截至目前为止并未发生任何变更。
根据北京市食品药品监督管理局(以下简称“北京市食药监局”)《北京市推动药品生产企业实施药品质量受权人制度的工作意见》(以下简称《工作意见》),“各企业应根据实施质量受权人制度的要求,并结合本企业的实际,建立企业内部质量受权人管理制度,把质量受权人的权力落实到位,为受权人履行职责提供必要的条件,同时确保受权人在履行职责时不受到企业内部因素的干扰。”
《工作意见》同时明确,“企业应保持质量受权人相对稳定,确因工作需要变更质量受权人时,企业应于变更之日起5个工作日内书面说明变更原因,并按程序上报《北京市药品生产企业质量受权人报告表》和签订的《药品生产企业质量授权书》等各项资料。”
李静女士于2015年3月1日被任命为公司质量总监(质量管理负责人)和质量受权人(质量受权人的授权自2015年3月1日至2017年2月28日生效),并根据相关规定分别在北京市药监局备案和向北京市海淀区食品药品监督管理局(以下简称“海淀区食药监局”)报告。
2017年2月27日公司新签署的《药品生产企业质量授权书》再次授权李静女士作为公司质量受权人,该项授权自2017年2月27日至2019年2月26日生效,且授权期间任何人员不得干扰质量受权人履行职责。
李静女士任职以来,接受了药品相关法律法规培训并严格依法执行各项规定,能够根据《北京科兴关键人员及生产质量体系部门负责人职责及授权管理》文件要求,履行质量管理负责人和质量受权人相关职责。
李静女士带领北京科兴的质量管理团队,保证了质量管理体系的有效运行。2015-2017年北京科兴均通过了国家食品药品监督管理总局(以下简称“国家局”)及北京市食药监局的GMP跟踪检查,在2018年1月通过了GMP五年再认证(并于4月13日正式获得药品GMP证书,编号:BJ20180327),在2018年3月通过了国家局GMP跟踪检查。公司疫苗批签发合格率100%。
除通过国内药品监管部门的检查外,北京科兴2017年以来还接受并通过了世界卫生组织(WHO)、古巴、巴基斯坦、泰国、孟加拉国、阿根廷等多个不同国际组织或国家的GMP检查及审计,甲型肝炎灭活疫苗孩尔来福也于2017年12月顺利通过了WHO预认证。
2018年4月17日以来,北京市食品药品监督管理局及海淀区食品药品监督管理局对北京科兴生产现场情况高度重视,先后多次现场检查,具体如下:
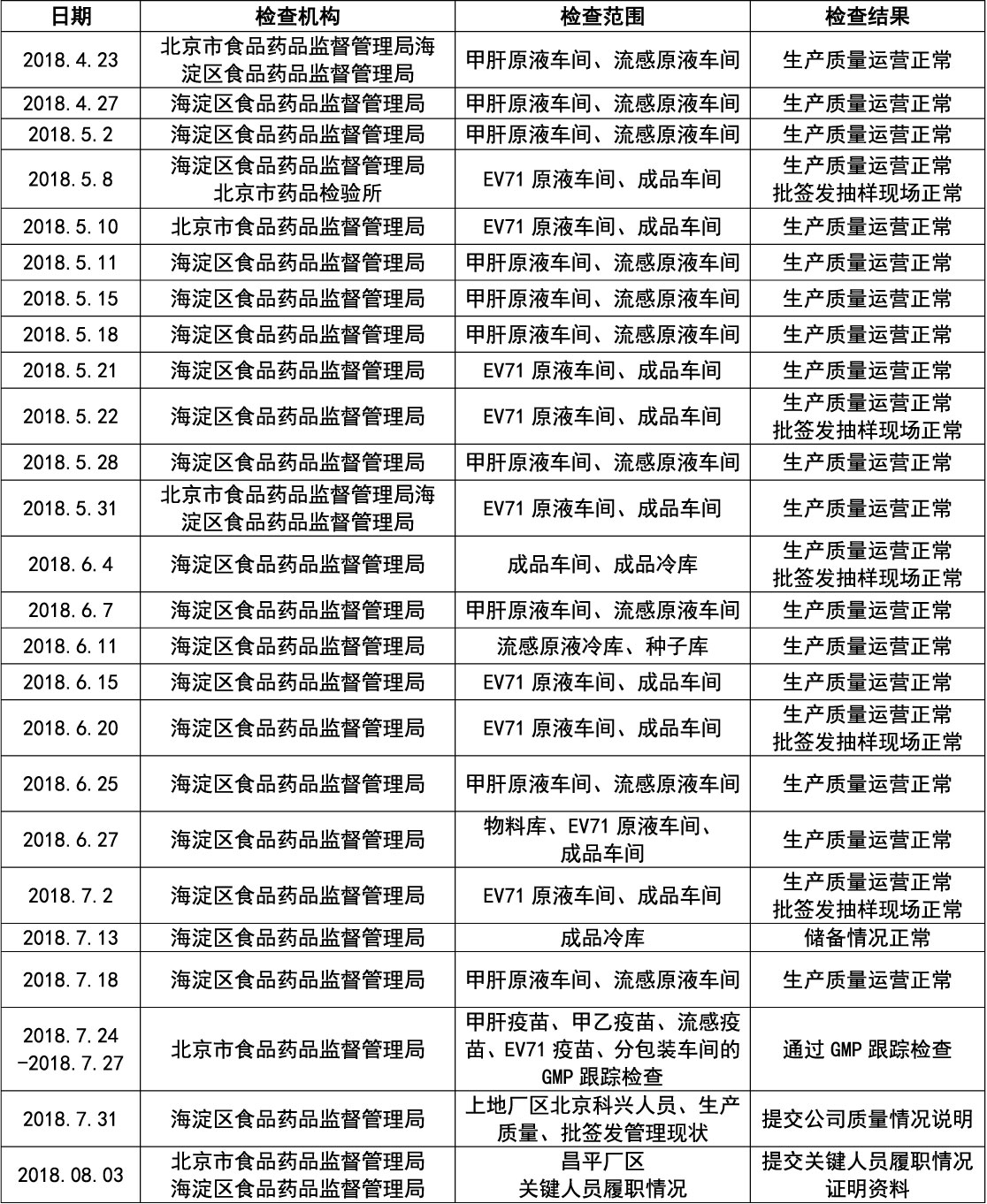
2018年4月17日,潘爱华及未名方面纠集多名不明身份的社会闲散人员突然闯入北京科兴,强行霸占、非法查封了北京科兴上地厂区的三座厂房(含办公区)、物料库房和食堂,暴力驱赶北京科兴正在上班的员工,并多次强行切断北京科兴三座生产楼和物料库房电源,导致正在进行生产的甲肝和流感原液生产中断。事件发生后公司在第一时间主动通知药监机构和CDC相关部门,公开透明告知一切情况。
针对受断电事件影响的在线产品及生产车间,北京科兴及时组织相关技术人员开展多次全面的风险评估,认为受断电事件影响的在线产品存在一定质量风险和不可预知的其它风险。北京科兴以对公众负责,对接种者负责的态度,本着产品质量第一的原则,为杜绝任何可能的质量隐患,消除因此次事件可能造成的群众疑虑,经全面评估,毅然决定销毁受此事件影响的所有在线产品,决不让一支有风险的疫苗放行出厂,确保所有放行出厂的疫苗产品的安全性和有效性。
最终北京科兴报废220万人份流感疫苗、350万支甲肝灭活疫苗的原液及23价肺炎球菌多糖疫苗生产的菌种,并于5月起暂停了甲肝灭活疫苗和流感疫苗的生产。此举导致北京科兴在2018-2019年流感季节将无法供应流感疫苗,在所有已中标国家和国内省份被迫弃标或无法响应新的招标。
北京市药监局及海淀区药监局对北京科兴生产现场情况高度重视,先后多次到北京科兴上地厂区和昌平厂区现场检查,公司生产质量运营正常。
“让中国儿童使用国际水平的疫苗,让世界儿童使用中国生产的疫苗”是北京科兴矢志不渝的奋斗目标。北京科兴所有批次的产品都按照严格的标准生产并得到了中国生物制品检定研究院的批签发核准。
截至2018年8月5日,北京科兴在2018年共有48批次的肠道病毒71型灭活疫苗(EV71疫苗)益尔来福®和17批次的甲肝灭活疫苗孩尔来福®获得批签发合格证书,批签发合格率100%。目前,北京科兴包括研发、生产、销售在内的所有业务都在按照原定计划正常开展和进行,在产和库存的EV71疫苗益尔来福®和甲肝灭活疫苗孩尔来福®都可以足量、正常地保障市场供应。
关于SINOVAC科兴
科兴控股生物技术有限公司(Sinovac Biotech Ltd.,SINOVAC 科兴)是一家总部位于中国、面向全球的生物制药企业,公司以“为人类消除疾病提供疫苗”为使命,专注于人用疫苗及相关生物制品的研究、开发、生产和供应,为全球疾病防控提供高质量疫苗产品和相关解决方案。
SINOVAC 科兴拥有多元化的疫苗产品组合,覆盖流感、病毒性肝炎、水痘、手足口病、脊髓灰质炎、肺炎球菌性疾病等多个重点领域。其中,甲型肝炎灭活疫苗孩尔来福®、Sabin 株脊髓灰质炎灭活疫苗(sIPV)和水痘减毒活疫苗已通过世界卫生组织(WHO)预认证。
在应对新兴传染病方面,SINOVAC 科兴具有领先优势,在SARS、H5N1、H1N1及新冠疫情等多次重大公共卫生事件中率先开展疫苗研发,并先后研制出全球首支SARS灭活疫苗(完成I期临床)、中国第一支大流行流感灭活疫苗(H5N1)盼尔来福®、全球首支甲型H1N1流感疫苗盼尔来福.1®,以及全球应用最广泛的新冠灭活疫苗克尔来福®。
除已上市产品之外,SINOVAC 科兴正持续推进涵盖联合疫苗、重组蛋白疫苗以及mRNA、抗体等新一代技术平台的创新研发管线,进一步拓展疾病预防的技术边界。
秉持对创新与全球健康的长期承诺,SINOVAC 科兴不断深化与科研机构、国际组织及本地合作伙伴的合作,拓展全球业务布局。通过加强技术协作、推动本地化生产与产业合作,公司致力于加快疫苗研发与供应速度,提升高质量疫苗在不同地区的可及性,更好地满足不同地区尚未满足的医疗需求,提升对未来公共卫生挑战的应对能力。
 中文
中文